Die Art und Weise, wie die Atome in einer Verbindung miteinander verknüpft sind, ist ausschlaggebend für die elementare Zusammensetzung und die Eigenschaften der Verbindung. Die Eigenschaften sind durch die Art der kleinsten Teilchen, aus denen die Verbindung letztlich besteht (Moleküle oder Ionen) und durch die Kräfte, die zwischen diesen Teilchen wirken bestimmt.
Chemische Bindungen sind Kräfte, die zwischen Teilchen wirken und so das chemische und physikalische Verhalten der Stoffe beeinflussen.
Bei der Betrachtung der in der Natur vorkommenden Stoffe stellt man fest, dass die Edelgase nur unter sehr extremen Bedingungen Verbindungen eingehen. Der Aufbau der Hülle von Edelgasatomen muss daher sehr stabil sein.
Alle übrigen Elemente haben das Bestreben, die gleiche Elektronenanordnung in ihren Schalen zu erreichen, wie sie das ihnen am nächsten liegende Edelgas aufweist, eine sog. Edelgaskonfiguration.
Dieses Streben nach der abgeschlossenen Achterschale der Edelgase (Ausnahme Helium), wird als Oktettregel bezeichnet und ist die Ursache für die Bildung von Bindungen und Verbindungen.
Die Elemente können die Edelgasschale erhalten, wenn sie entweder Elektronen abgeben oder aufnehmen.
Ob ein Element bei der Bindungsbildung Elektronen abgibt oder aufnimmt, hängt von seiner Elektronegativität ab.
Die Elektronegativität EN ist ein Mass für das Vermögen eines Atoms, Bindungselektronen an sich zu ziehen.
Je kleiner der Atomradius eines Elements ist und je mehr Valenzelektronen es besitzt, umso besser kann es seine Elektronen festhalten und weitere anlagern. Es besitzt eine grosse EN und nimmt leicht Elektronen auf. Solche Elemente gehören zu den Nichtmetallen.
Je grösser der Atomradius eines Elements ist und je weniger Valenzelektronen es besitzt, umso schlechter kann es seine Elektronen festhalten oder gar weitere aufnehmen. Es hat eine kleine EN und die Tendenz, Elektronen abzugeben. Solche Elemente gehören zu den Metallen.
Aus der Art, wie die Atome bei der Bindungsbildung eine Edelgaskonfiguration erreichen ergeben sich die verschiedenen Bindungsarten.
Die Elektronegativität nimmt im Periodensystem von links nach rechts und von unten nach oben zu. D.h. das Element mit der grössten EN ist das Fluor und das Element mit der kleinsten EN ist das Francium.
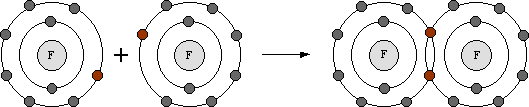
Vereinigt man ein Element mit vergleichsweise niedriger EN (Metall) und ein Element mit relativ grosser EN (Nichtmetall), so kommt es zur Übertragung von Elektronen bis beide Elemente die ihnen am nächsten liegende Edelgaskonfiguration erreicht haben. Dabei entsteht eine ionische Verbindung, in der geladene Teilchen durch elektrostatische Kräfte in einem Kristallgitter zusammengehalten werden.
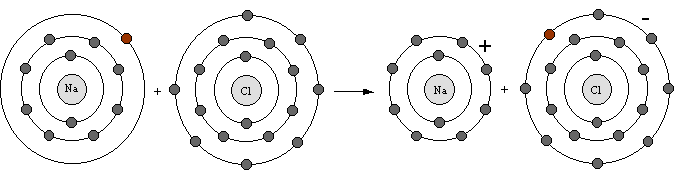
Bei der Reaktion von Natrium mit Chlor wird ein Elektron vom Natriumatom in die äusserste Schale des Chloratoms übertragen und beide Atome erreichen so Edelgaskonfiguration.
Natrium wird isoelektronisch mit Neon,
Chlor wird isoelektronisch mit Argon.
Das Natriumatom hat nun aber nur noch 10 Elektronen in der Schale, gegenüber 11 Protonen im Kern. Es ist zu einem geladenen Teilchen, zu einem Ion, mit der Ladung +1 geworden.
Das Chloratom besitzt nun 1 Elektron mehr als es Protonen im Kern aufweist und ist zu einem Ion der Ladung -1 geworden.
Positive Ionen werden als Kationen, negative Ionen als Anionen bezeichnet.

Die Vorgänge lassen sich bequemer in der Elektronenstrichformel darstellen. Dabei werden die mit Valenzelektronen besetzten s- und p-Orbitale der äussersten Schale als Punkt (einfach besetzt) oder als Strich (doppelt besetzt) um das Elementsymbol angeordnet.
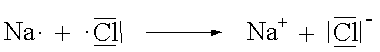
Die Gesamtzahl der Elektronen, die das Natrium verliert muss gleich der Gesamtzahl an Elektronen sein, die das Chlor aufnimmt. Daher muss die Zahl der Natriumionen auch gleich der Anzahl Chloridionen sein.
Die entstandenen Ionen ziehen sich aufgrund ihrer entgegengesetzten Ladungen an und bilden ein Ionengitter (Kristall). Die wirkenden elektrostatischen Anziehungskräfte sind relativ stark und werden als Ionenbindung bezeichnet. Es bildet sich ein streng geordnetes Gitter, das nur mit grossem Energieaufwand (Gitterenergie) zerstört werden kann (hoher Schmelzpunkt).
Obwohl die Zahl der Natriumionen im Kristall gleich der Zahl der Chlorid-Ionen ist, können keine individuellen Ionenpaare unterschieden werden. Vielmehr ist jedes Natrium-Ion von sechs Chlorid-Ionen und jedes Chlorid-Ion von sechs Natrium-Ionen umgeben. Bei dieser Anordnung wird die Abstossung der gleichgeladenen Ionen durch die Anziehung der entgegengesetzt geladenen Ionen überkompensiert.
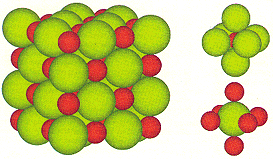
Die Summenformel für die ionische Verbindung aus Natrium und Chlor ist NaCl. Diese Formel beschreibt das kleinste ganzzahlige Teilchenverhältnis der im Kristall vorhandenen Ionen.
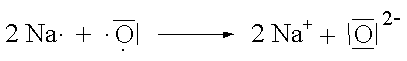
Wenn Sauerstoff eine Ionenbindung eingeht, nimmt jedes Sauerstoffatom zwei Elektronen auf und erreicht damit die Neon-Konfiguration. Das entstehende Ion erhält die Ladung -2. Bei der Reaktion von Natrium mit Sauerstoff werden für jedes Sauerstoffatom zwei Natriumatome benötigt, damit das Gleichgewicht zwischen Elektronenverlust und Elektronengewinn hergestellt werden kann. Das Ionenverhältnis im Ionengitter ist deshalb 2 : 1 und die Formel von Natriumoxid Na2O.
Ionenbildung |
Summenformel |
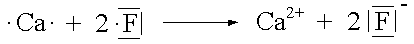 |
CaF2 |
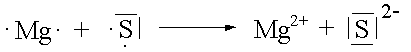 |
MgS |
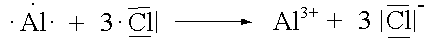 |
AlCl3 |
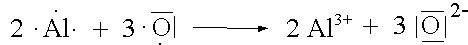 |
Al2O3 |
Bindungspartner |
Metall und Nichtmetall |
Edelgaskonfiguration durch |
Elektronenübergabe von Metall auf Nichtmetall |
Kleinste Teilchen |
Ionen |
Bindungskraft |
elektrostatische Anziehung |
Aufbau der Verbindung |
Ionengitter, Kristall |
Summenformel |
Indices geben das Verhältnis der am Gitter beteiligten Ionen an |
Verbindungen, die aus einem Ionengitter aufgebaut sind, werden auch als Salze bezeichnet.
Eigenschaft |
Begründung |
hohe Schmelz- und Siedepunkte |
starke Anziehung zwischen den Ionen, regelmässige Ordnung |
harte Kristalle |
starke Ionenanziehung |
spröde |
wenn Ionengitter verschoben, kommt es zur Abstossung |
elektrisch leitend im flüssigen Zustand |
Ionen sind als Ladungsträger im flüssigen Zustand beweglich |
Dieser Bindungstyp wird auch als Kovalente Bindung oder Elektronenpaarbindung bezeichnet.
Zwei Atome, die beide eine grosse EN aufweisen (zwei Nichtmetallatome), können die erstrebte Edelgaskonfiguration erhalten, wenn jedes Atom ein Elektron für ein gemeinsames Elektronenpaar zur Verfügung stellt. Dieses Elektronenpaar hält sich dann in den äussersten Schalen beider Atome auf und bewirkt dadurch eine Bindung, eine Atombindung.
(gemeinsame Elektronenpaare werden als Bindestriche zwischen den Symbolen gezeichnet.)
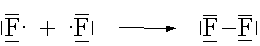
Die Bindungselektronen halten sich mehrheitlich zwischen den beiden Atomkernen auf. Die Stärke dieser Bindung resultiert somit aus der Anziehung zwischen den positiv geladenen Kernen und der negativen Ladungswolke der Bindungselektronen.
Durch Atombindungen vereinigte Atome bilden einen neutralen Atomverband, ein Molekül.
Jedes Nichtmetallatom bildet mit seinem Reaktionspartner soviele gemeinsame Elektronenpaare, wie ihm Elektronen bis zur nächsten Edelgaskonfiguration fehlen.
Zwischen zwei Atomen kann sich also auch mehr als eine Atombindung ausbilden. Man spricht dann von einer Mehrfachbindung.
Doppelbindung |
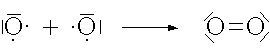 |
Dreifachbindung |
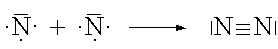 |
Die Bindung kann selbstverständlich auch zwischen verschiedenartigen Atomen auftreten.
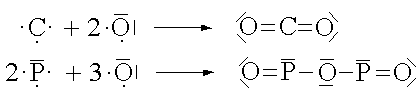
Die Summenformel einer Molekülverbindung beschreibt, anders als bei den Ionenverbindungen, eine abgeschlossene Einheit, ein Molekül. Die Indices nach den Symbolen der Elemente geben die Anzahl der am Molekül beteiligten Atome des betreffenden Elementes an.
F2 |
O2 |
N2 |
CO2 |
P2O3 |
Die Atombindung ist eine sehr starke Bindungskraft, der Zusammenhalt eines Moleküls also gross.
Zwischen den Molekülen wirken aber wegen der fehlenden Ladungen nur ganz schwache Kräfte (z.B. Massenanziehung). Es bilden sich, wenn überhaupt, Molekülgitter mit geringem Zusammenhalt, die leicht schmelzbar und weich sind.
Aus der Elektronenstrichformel von Molekülen ist ersichtlich, dass jedes Atom ausser dem Wasserstoff in einem Molekül 4 Elektronenpaare um sich hat. Da diese aber gleich geladen sind, stossen sie sich ab. Die grösste Entfernung von vier Punkten auf einer Kugel sind die Entfernungen der vier Ecken eines Tetraeders.
Daraus ergibt sich, dass die Atombindung gerichtet ist. Die vierbindigen Elemente bilden Moleküle von der räumlichen Struktur eines Tetraeders. Der Winkel zwischen zwei Bindungselektronenpaaren beträgt 109°28'.
Ist das Element nur dreibindig, bildet die vierte Ecke das freie Elektronenpaar und das Molekül hat die Struktur einer Pyramide. Ist es nur zweibindig, sind sogar zwei Ecken durch freie Elektronenpaare besetzt, sodass nur noch ein gleichschenkliges Dreieck übrig bleibt.
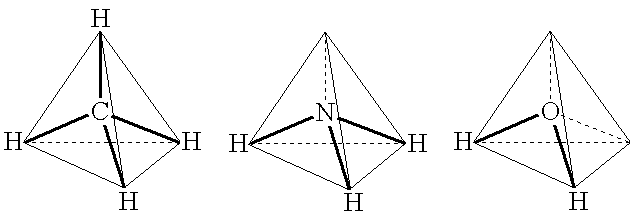
Methan |
Ammoniak |
Weitere Beispiele:
Molekülbildung |
Formel |
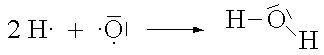 |
H2O |
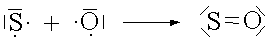 |
SO |
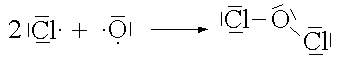 |
Cl2O |
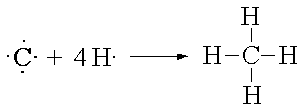 |
CH4 |
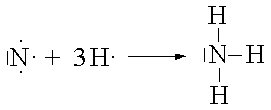 |
NH3 |
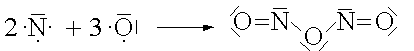 |
N2O3 |
Bindungspartner |
Nichtmetall und Nichtmetall |
Edelgaskonfiguration durch |
Bildung von gemeinsamen Elektronenpaaren |
Kleinste Teilchen |
Moleküle |
Bindungskraft |
elektrostatische Anziehung zwischen der Bindungselektronenwolke und den positiven Atomrümpfen |
Aufbau der Verbindung |
Molekülgitter |
Summenformel |
Indices geben die Anzahl Atome der Elemente im Molekül an |
Molekülverbindungen werden auch als flüchtige Stoffe bezeichnet. Ihr Aufbau als Molekülgitter gibt ihnen spezielle Eigenschaften.
Eigenschaft |
Begründung |
weich |
schwache Anziehung im Gitter |
tiefe Schmelz- und Siedepunkte, meist flüssig oder gasig |
nur schwache Wechselwirkungen zwischen den Molekülen, nur bei grossen Molekülen fest |
nicht leitend |
Moleküle tragen keine Ladung |
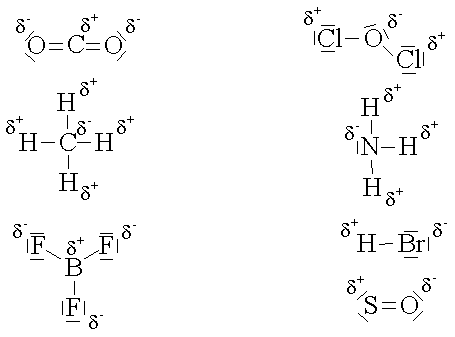
Eine reine Atombindung liegt nur bei Molekülen vor, die aus gleichartigen Atomen aufgebaut sind. Besteht ein Molekül aus verschiedenartigen Atomen, wie z.B. bei den Halogenwasserstoffen, so wird sich das gemeinsame Elektronenpaar mehr auf der Seite des Halogenatoms befinden, da dieses eine grössere Elektronegativität besitzt.
Durch diese Elektronenverschiebung zum Halogenatom wird dieses Atom partiell negativ und das Wasserstoffatom partiell positiv geladen. Man bezeichnet diese kleinen Teilladungen, die stets unter 1 e liegen, mit d- und d+.
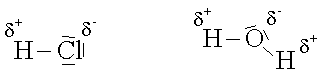
Für den Bindungscharakter einer Atombindung ist die Differenz der Elektronegativität entscheidend. Beträgt diese Differenz Null, so liegt eine reine Atombindung vor. Je grösser die Differenz ist, umso stärker ist der Ionencharakter ausgeprägt.
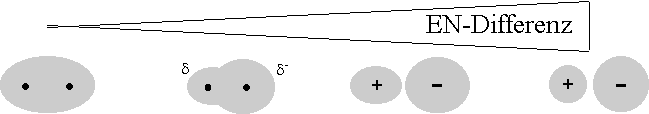
Atom- |
polarisierte |
verzerrte |
Ionen- |
Ein Molekül mit je einem Zentrum positiver und negativer Ladung wird als Dipol bezeichnet. Polarisierte Atombindungen können zu Dipolen führen, wenn die räumliche Struktur des Moleküls so ausgelegt ist, dass der Ladungsschwerpunkt aller positiver Teilladungen nicht mit dem Schwerpunkt der negativen Teilladungen zusammenfällt. Der Dipol ist umso stärker, je grösser die Teilladungen sind und je weiter die Ladungsschwerpunkte auseinanderliegen.
kein Dipol |
Dipol |
Die Ausrichtung der Dipole und die elektrostatischen Anziehungskräfte zwischen den Polen bewirken eine verminderte Flüchtigkeit der Dipolverbindungen gegenüber den unpolaren Verbindungen.
Eine Bindung zwischen Metallatomen lässt sich weder durch einen Elektronenübergang noch durch gemeinsame Elektronenpaare herbeiführen. In diesem Falle kommt es dadurch zu einer Bindung, dass alle Metallatome ihre Elektronen der äussersten Schale abgeben und dadurch Edelgaskonfiguration erhalten. Die freien Elektronen, die sich wie ein "Elektronen-Nebel" verhalten, bewirken den Zusammenhalt der positiven Metallionen und eine gleichmässige Verteilung der Ladung. Es bildet sich ein Metallgitter, in dessen Gitterpunkten sich die Metallrümpfe befinden und in dessen Zwischenräumen die freien Elektronen mit grosser Geschwindigkeit hin- und herströmen. Die Bewegung der Elektronen in einer bestimmten Richtung ist aber nicht sehr gross, weil sie häufig miteinander und mit den Metallionen zusammenstossen.

Legierungen sind Kombinationen zweier oder mehrerer Metallatomsorten in einem Metallgitter. Die Metalle sind in beliebigen, von den Valenzelektronenzahlen unabhängigen, Verhältnissen mischbar. Dabei können sich die verschiedenen Atomsorten regellos über das ganze Gitter verteilen. Man zählt Legierungen deshalb nicht zu den Verbindungen.
In gewissen Fällen ist trotzdem eine über die ganze Legierung konstante Zusammensetzung anzutreffen. Man spricht dann von einer "intermetallischen Verbindung". Es liegen aber auch hier keine echten Bindungen vor, die durch Valenzelektronen vermittelt werden, sondern nur ein gleichbleibendes Ordnungsprinzip der verschiedenen Metallrümpfe im Gitter.
Bindungspartner |
Metalle |
Edelgaskonfiguration durch |
Abgabe von Elektronen in den freien Raum des Gitters |
Kleinste Teilchen |
Atomrümpfe (Metallkationen) |
Bindungskraft |
elektrostatische Anziehung zwischen den beweglichen Elektronen und den Atomrümpfen |
Aufbau der Verbindung |
Metallgitter |
Summenformel |
keine |
Die besonderen "metallischen" Eigenschaften dieser Stoffe lassen sich aus dem Aufbau des Metallgitters ableiten.
Eigenschaft |
Begründung |
hohe Schmelz- und Siedepunkte |
starke Anziehung zwischen den Metallrümpfen und den Elektronen |
oft weich |
Anziehung schwächer als im Ionengitter, da Elektronen beweglich |
dehnbar |
Gitterebenen gegeneinander verschiebbar ohne Abstossung, da Elektronen beweglich |
elektrisch leitend im festen Zustand |
Elektronen sind als Ladungsträger beweglich |
Nebenvalenzbindungen gehen vorwiegend Teilchen ein, deren Atome bereits eine nach der Oktettregel abgeschlossene Aussenschale aufweisen. Die Bindungskräfte können aus der elektrostatischen Anziehung zwischen Dipolen und Ionen resultieren oder kovalenter Natur sein.
Unpolare Moleküle werden durch Van der Waal'sche Kräfte zusammengehalten. Es handelt sich hierbei um äusserst schwache Kräfte, die jeglicher Materie zu eigen sind. Sie werden durch die Elektronenbewegung erzeugt und manchmal auch als fluktuierende Dipole bezeichnet. So kann zu einem gegebenen Augenblick ein Teil eines sonst neutralen Moleküls eine sehr kleine negative Ladung erhalten, weil es eine etwas über dem Durchschnitt liegende Elektronendichte aufweist. Im nächsten Augenblick jedoch kann derselbe Molekülteil aufgrund einer leichten Elektronenverarmung relativ positiv sein.
Die Stärke der Van der Waal's-Kräfte hängt von der Grösse und der Länge des Moleküls ab. Sie beeinflussen die physikalischen Eigenschaften von Molekülverbindungen. So hat Pentan wegen seinem grösseren Molekül den höheren Siedepunkt als Methan, und das gradkettige Pentan hat einen höheren Siedepunkt als das gleichgrosse, aber kugelförmige 2,2-Dimethylpropan.
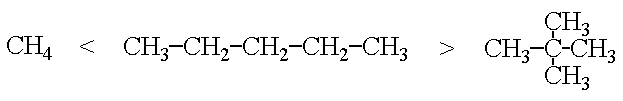
Polare Molekülverbindungen sind durch die Ausrichtung der Dipole und die zusätzlichen elektrostatischen Anziehungskräfte weniger flüchtig als die unpolaren.
Die Stärke der Bindungskraft wird mit zunehmender Elektronegativitätsdifferenz zwischen den Bindungspartnern im Molekül grösser. Besonders ausgeprägt ist diese Erscheinung in den Verbindungen der Wasserstoffs mit stark elektronegativen Elementen.
Der Wasserstoff stellt dabei den positiven Pol dar und ist daher in der Lage, mit einem elektronegativen Atom, das einen negativen Pol bildet, in Beziehung zu treten. Der Wasserstoff bildet dadurch eine auf Dipolkräften beruhende Bindung zwischen den Atomen, die man Wasserstoffbrückenbindung nennt.
Die Bindung kann zwischen Atomen des gleichen Moleküls, intramolekular, oder zwischen zwei Molekülen, intermolekular, auftreten. Die Festigkeit nimmt vom Fluor über Sauerstoff, Stickstoff bis zum Schwefel ab. Zur Kennzeichnung schreibt man mehrere Punkte zwischen den beiden Atomen.
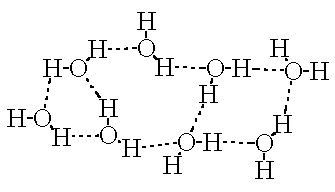
Die intermolekulare Wasserstoffbrückenbindung führt zu einer Assoziation der Moleküle, die vorallem bei OH-haltigen Verbindungen auftritt (Wasser, Wasserstoffperoxid, Alkohole, Phenole, sauerstoffhaltige Säuren). Dabei entstehen Doppelmoleküle, Molekülketten, ringförmige Verknüpfungen und ganze Molekülnetze. Daraus resultiert eine ganze Reihe von starken Einflüssen auf die physikalischen Eigenschaften dieser Stoffe.
| - | abnormal hohe Schmelz-/Siedepunkte sowie Schmelz-/Verdampfungswärmen (Wasser, Fluorwasserstoff, Ammoniak) |
| - | hohe Dichten (Anomalie des Wassers) |
| - | Wasserlöslichkeit organischer Verbindungen (Alkohole, Amine, Carbonsäuren) |
| - | hohe Viskosität von Flüssigkeiten (Glycerin) |
Zentralteilchen (mit nach der Oktettregel abgeschlossener Aussenschale) können Liganden (Atome, Ionen oder Dipolmoleküle) binden und so Teilchen höherer Ordnung, sog. Komplexe bilden. Die Anzahl der Liganden ist die Koordinationszahl (meist 2, 4 oder 6). Komplexe werden im allgemeinen in eckige Klammern geschrieben.
K[Ag(CN)2] |
Zentralatom: |
Ag+ |
Ligand: |
CN- |
|
Koordinationszahl: |
2 |
Die Bindung zwischen Zentralteilchen und Ligand wird als Koordinationsbindung bezeichnet und erfolgt über ein gemeinsames Elektronenpaar oder als elektrostatische Wechselwirkung mit Ionen oder Dipolmolekülen.
Beispiele
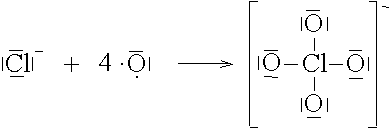
Das Cl--Ion hat 4 freie Elektronenpaare, an die sich 1 bis 4 Sauerstoffatome anlagern können, die dadurch jeweils Edelgaskonfiguration erhalten.
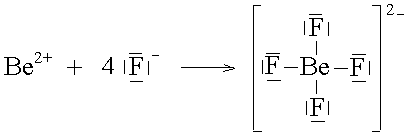
Das Beryllium-Kation lagert 4 Fluorid-Ionen an und erzielt damit Edelgaskonfiguration.
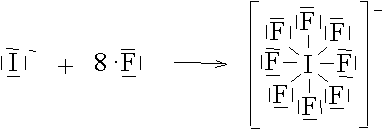
Das Iod-Anion verfügt über vier freie Elektronenpaare, es kann 2, 4,6 oder 8 Fluoratome aufnehmen.
Das Cu2+-Ion lagert 4 Ammoniak-Moleküle an. Die 4 freien Elektronenpaare der NH3-Moleküle bilden um das Kation eine zusätzliche äusserste Achterschale.
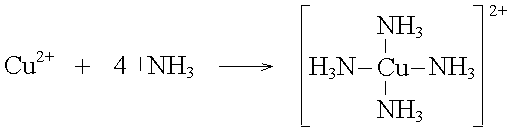
Fe2+-Ionen umgeben sich in wässriger Lösung mit 6 Wassermolekülen. Die Bindung entsteht durch die elektrostatische Anziehung zwischen dem Kation und dem Dipolmolekül Wasser.
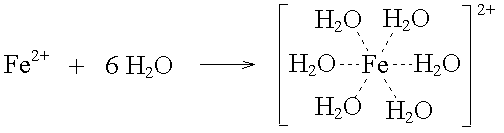
Co3+-Ionen werden von 6 Fluoridionen umgeben. Die negativ geladenen Ionen sind durch die elektrostatische Anziehung an das Kation gebunden.
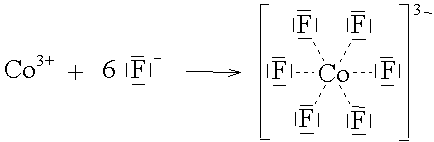
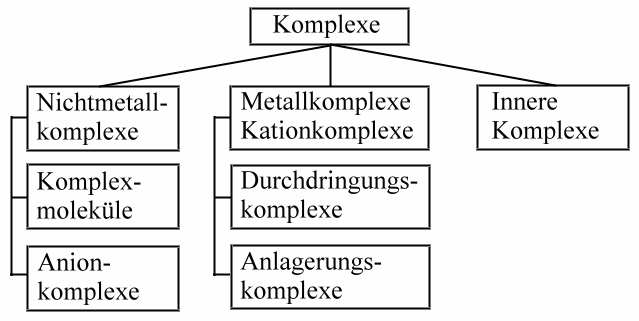
Das Tentralteilchen gehört immer zu einem Nichtmetall.
Nichtmetallkomplexe sind sehr stabil. Sie zerfallen bei chemischen Reaktionen nicht, sondern reagieren als Ganzes.
Molekülkomplexe
Das Zentralteilchen ist ein Nichtmetallatom.
An die freien Elektronenpaare eines Moleküls lagern sich meist Sauerstoffatome durch eine Koordinationsbindung an.
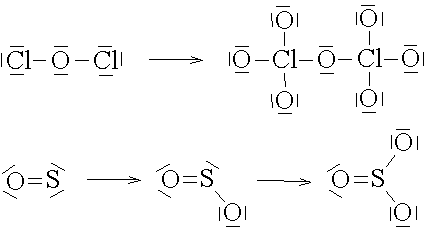
Nach diesen Formeln könnte man annehmen, dass die Sauerstoffatome durch Einfachbindungen und Doppelbindungen an das Zentralatom gebunden sind. In Wirklichkeit sind aber alle Sauerstoffatome in gleicher Weise gebunden. Die Bindungselektronen sind delokalisiert. Dieser Umstand wird als Mesomerie bezeichnet und durch mesomere Grenzstrukturen wiedergegeben.
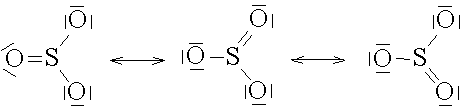
Anstelle der Elektronenstrichformeln oder der mesomeren Grenzstrukturen werden oft die einfacheren Valenzstrichformeln verwendet. Darin werden die Atome unter Berücksichtigung ihrer räumlichen Anordnung mit Valenz- oder Wertigkeitsstrichen untereinander ver bunden.
Achtung: Die Valenzstriche stellen keine Bindungselektronenpaare dar wie in der Elektronenstrichformel !
Anionkomplexe
Anionkomplexe gehören ebenfalls zu den Nichtmetallkomplexen. Das Zentralteilchen ist ein Nichtmetallion, dessen äusserste Schale durch Elektronen eines metallischen Partners aufgefüllt ist. Die Sauerstoffatome (Liganden) bilden mit den 4 Elektronenpaaren des Anions Koordinationsbindungen.
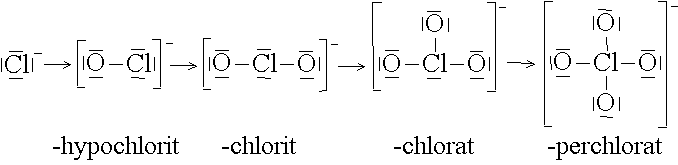
Auf diese Weise lassen sich von vielen Anionen ganze Reihen von Anionkomplexen ableiten:
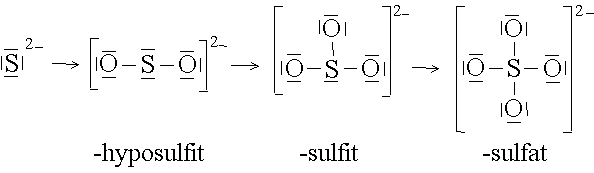
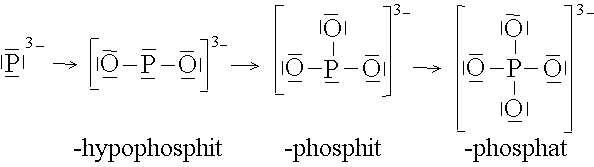
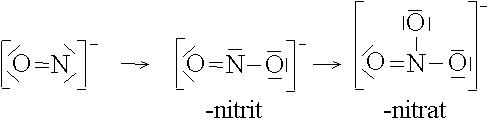
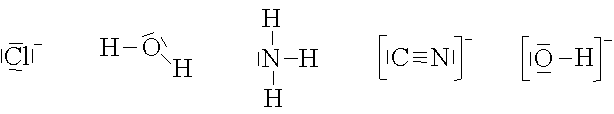
Das Zentralteilchen ist immer ein Metall-Kation. Deshalb werden Metallkomplexe auch als Kationkomplexe bezeichnet.
An ein Metallkation werden nur Liganden mit abgeschlossenen Aussenschalen, also Ionen oder Moleküle, angelagert. Die am häufigsten vorkommenden Liganden sind:
Durchdringungskomplexe
Von den freien Elektronenpaaren der Liganden wird jeweils eines eingesetzt, um eine Bindung mit dem Zentralkation einzugehen. Die von den Liganden gelieferten Elektronen bilden eine neue Schale um das Kation, die sowohl dem Kation als auch den Liganden gleichzeitig gehört. Auf diese Weise wird erreicht,
dass das Zentral-Kation die Elektronenkonfiguration des nächst höheren Edelgases bekommt oder dieser mindestens nahe kommt. Die Bindung der Liganden an das Zentralkation ist somit eine Koordinationsbindung.
Durchdringungskomplexe zeichnen sich durch eine recht gute Stabilität aus. Sie werden vorallem von Metallen der vierten bis achten Nebengruppe gebildet.
Cu2+ + 4 NH3 |
 |
[Cu(NH3)4]2+ |
Fe3+ + 6 [CN]- |
 |
[Fe(CN)6]3- |
Anlagerungskomplexe
Hier wird die Bindung zwischen Zentralkation und Liganden durch elektrostatische Anziehungskräfte hergestellt. Als Liganden treten Dipolmoleküle auf. Anlagerungskomplexe haben nur geringe Stabilität. Die bekanntesten Beispiele sind die Hydrate der Nebengruppenmetallkationen und einige Komplexe mit Ammoniak.
[Fe(H2O)6]2+ |
[Cu(H2O)4]2+ |
[Zn(NH3)6]2+ |
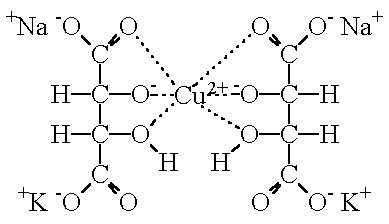
Einige Metallionen können in wässriger Lösung mit organischen Molekülen, die durch Metall ersetzbaren Wasserstoff und polare Gruppen enthalten feste Komplexe bilden. Sie sind meist schwer löslich und zeigen eine auffallende Farbe.
Das Metall ist in zweifacher Weise gebunden: Einerseits hat es den Wasserstoff ersetzt und ist daher über eine Ionenbindung gebunden, andererseits ist es auch durch Nebenvalenzbindungen an polare Gruppen des Moleküls gebunden.
Besser als die Wertigkeit gibt die Oxidationszahl die Bindungsverhältnisse in einer Verbindung wieder. Die Oxidationszahl ist eine formale Kennziffer dafür, wieviele Elektronen ein Element in einer Verbindung aufgenommen oder abgegeben hat.
Definition:
Die Oxidationszahl eines Atoms in einer Verbindung entspricht seiner theoretischen Ladung, die es erhält, wenn alle Bindungselektronen vollständig dem jeweils elektronegativeren Bindungspartner zugeteilt werden.
Oxidationszahlen werden über dem Symbol als römische Ziffer mit Vorzeichen geschrieben.
Für die Ermittlung der Oxidationszahlen in Verbindungen gelten aufgrund der Wertigkeiten und Elektronegativitäten der Elemente die folgenden, nach abnehmender Priorität geordne-ten, Regeln:
1. |
Jedes ungebundene Atom hat die Oxidationszahl 0, ebenso Atome in Molekülen aus gleichartigen Atomen. |
||
2. |
Fluor hat immer die Oxidationszahl -I. |
||
3. |
Metalle haben immer positive Oxidationszahlen. Für Hauptgruppenmetalle entspricht sie der Hauptgruppennummer. |
||
4. |
Wasserstoff hat immer die Oxidationszahl +I (ausser in Metallhydriden (-I). |
||
5. |
Sauerstoff hat immer die Oxidationszahl -II (ausser in Peroxiden (-I) und in Fluorverbindungen. |
||
6. |
Die kleinst mögliche Oxidationszahl von Nichtmetallen entspricht der Hauptgruppennummer minus acht. Sie nehmen diese in Ionenverbindungen ein. Die grösstmögliche Oxidationszahl entspricht der Hauptgruppennummer. |
||
7. |
Die Summe der Oxidationszahlen aller Atome in einem Molekül ist Null, in Ionen entspricht sie der Ionenladung. |
Beispiele:
+II -II |
-III +I |
+IV -II |
+II -I |
||||
a) |
CaO |
b) |
NH3 |
c) |
CO2 |
d) |
FeCl2 |
0 |
+I -V -II |
+I +VI -II |
+I +VII -II |
||||
e) |
F2 |
f) |
HNO3 |
g) |
H2Cr2O7 |
h) |
KMnO4 |
+VI -II |
+I -I |
+I +V -II |
+I +III -I |
||||
i) |
SO3 |
k) |
H2O2 |
l) |
H3PO4 |
m) |
LiAlH4 |
+I +IV -II |
+VI -II |
+IV -II |
+I +III -I |
||||
n) |
H2SO3 |
o) |
SO42- |
p) |
CO32- |
q) |
NaBH4 |
+V -II -I |
+VII -II |
+I +III +IV -V |
+II/+III -II |
||||
r) |
POCl3 |
s) |
ClO4- |
t) |
K3[Fe(CN)6] |
u) |
Fe3O4 |
Die Oxidationszahlen sind ein gutes Hilfsmittel zur Beurteilung und Formulierung von Redoxreaktionen.
Binäre (nur aus zwei Elementsorten bestehende) Verbindungen werden anhand der folgenden Punkte benannt:
1. |
Bei Salzen steht der positive Bestandteil (Kation) vor dem negativen (Anion). |
2. |
Bei Molekülverbindungen richtet sich der erste Bestandteil nach folgender Reihenfolge: |
3. |
Der Elementname des ersten Bestandteils bleibt unverändert, der vom lateinischen abgeleitete Wortstamm des zweiten Elements erhält die Endung -id. |
O |
-oxid |
S |
-sulfid |
F |
-fluorid |
N |
-nitrid |
Cl |
-chlorid |
P |
-phosphid |
Br |
-bromid |
H |
-hydrid |
I |
-iodid |
C |
-carbid |
4. |
Die Indices der Summenformel werden durch griechische Zahlwörter angegeben, die man den Namen der Elemente, auf die sie sich beziehen voranstellt. |
Index |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Zahlwort |
mono |
di |
tri |
tetra |
penta |
hexa |
hepta |
octa |
|
Die Silbe mono wird am Anfang eines Namens nie verwendet. |
5. |
Häufig wird auch die Stock'sche Bezeichnungsweise benutzt. Dabei wird die Oxidationsstufe eines Elementes als römische Ziffer (ohne Vorzeichen und in Klammern) hinter dessen Namen gesetzt. |
Beispiele:
OF2 |
Sauerstoffdifluorid, Sauerstoff(II)-fluorid |
P2O3 |
Diphosphortrioxid, Phosphor(III)-oxid |
MnO2 |
Mangandioxid, Mangan(IV)-oxid |
FeCl3 |
Eisentrichlorid, Eisen(III)-chlorid |
Einige Verbindungen werden nur mit Trivialnamen bezeichnet:
H2O |
Wasser |
CH4 |
Methan |
NH3 |
Ammoniak |
HCl |
Chlorwasserstoff |
H2S |
Schwefelwasserstoff |
Es gelten die folgenden Regeln:
1. |
Das Kation wird vor dem Anion benannt. |
|
2. |
Die Bestandteile des Komplexions werden in folgender Reihenfolge genannt: |
|
|
a) |
Koordinationszahl |
|
b) |
Liganden |
H- |
hydrido |
O2- |
oxo |
Cl- |
chloro |
O22- |
peroxo |
NO2- |
nitro |
N3- |
azido |
ClO- |
hypochlorito |
NH2- |
amido |
CN- |
cyano |
CH3O- |
methoxo |
S2- |
thio |
CH3COO- |
acetato |
SO42- |
sulfato |
H2O |
aqua |
OH- |
hydroxo |
NH3 |
ammin |
|
c) |
Zentralteilchen |
Pb |
plumbat |
Fe |
ferrat |
Au |
aurat |
C |
carbonat |
Cu |
cuprat |
S |
sulfat |
Ag |
argentat |
N |
nitrat |
Al |
aluminat |
Cl |
chlorat |
Sn |
stannat |
P |
phosphat |
|
d) |
Oxidationszahl |
Beispiele:
K4[Fe(CN)6] |
Kaliumhexacyanoferrat(II) |
K[Ag(CN)2] |
Kaliumdicyanoargentat(I) |
[Cu(NH3)4]Cl2 |
Tetramminkupfer(II)-chlorid |
Na2[Pb(OH)6] |
Natriumhexahydroxoplumbat(IV) |
[Co(H2O)(NH3)5](C2O4)3 |
Aquapentammincobalt(VI)-ethandioat |
Mg3(PO4)2 |
Magnesiumtetroxophosphat(V) |
K2SO3 |
Kaliumtrioxosulfat(IV) |
Li[AlH4] |
Lithiumtetrahydridoaluminat(III) |
[Ni(NH3)6]SO4 |
Hexamminnickel(II)-tetroxosulfat(VI) |
KClO4 |
Kaliumtetroxochlorat(VII) |
Na3[FeCl4] |
Natriumtetrachloroferrat(III) |
KClO |
Kaliummonoxochlorat(I) |
Al(NO3)3 |
Aluminiumtrioxonitrat(V) |
1) |
SO2 |
Schwefeldioxid, Schwefel(IV)-oxid |
2) |
NaBrO4 |
Na-tetroxobromat(VII), Na-perbromat |
3) |
P2O5 |
Diphosphorpentoxid, Phosphor(V)-oxid |
4) |
Na2SO4 |
Natriumtetroxosulfat(VI), Natriumsulfat |
5) |
[Fe(H2O)6]SO4 |
Hexaquaeisen(II)-sulfat |
6) |
MgO |
Magnesiumoxid |
7) |
[Cu(H2O)4]Br2 |
Tetraquakupfer(II)-bromid |
8) |
CuCl2 |
Kupfer(II)-chlorid |
9) |
NaNO2 |
Natriumdioxonitrat(III), Natriumnitrit |
10) |
SO3 |
Schwefeltrioxid, Schwefel(VI)-oxid |
11) |
N2O3 |
Distickstofftrioxid, Stickstoff(III)-oxid |
12) |
KIO3 |
Kaliumtrioxoiodat(V), Kaliumiodat |
13) |
Na3[Cu(CN)4] |
Natriumtetracyanocuprat(I) |
14) |
Fe2O3 |
Eisen(III)-oxid, Eisentrioxid |
15) |
K3[Fe(CN)6] |
Kaliumhexacyanoferrat(III) |
16) |
HBr |
Bromwasserstoff, Hydrogenbromid |
17) |
AgNO3 |
Silbertrioxonitrat(V), Silbernitrat |
18) |
Cl2O |
Dichlormonoxid, Chlor(I)-oxid |
19) |
KClO2 |
Kaliumdioxochlorat(III), Kaliumchlorit |
20) |
CO |
Kohlenstoffmonoxid, Kohlenstoff(II)-oxid |
21) |
CaSO3 |
Calciumtrioxosulfat(IV), Calciumsulfit |
22) |
[Zn(NH3)6]Cl2 |
Hexamminzink(II)-chlorid |
23) |
H2S |
Schwefelwasserstoff, Dihydrogensulfid |
24) |
[Ag(NH3)2]NO3 |
Diamminsilber(I)-nitrat |
25) |
Cl2O7 |
Dichlorheptoxid, Chlor(VII)-oxid |
26) |
KClO |
Kaliummonoxochlorat(I), K-hypochlorit |
27) |
K2[Pb(NO2)4] |
Kaliumtetranitroplumbat(II) |
28) |
MnO2 |
Mangan(IV)-oxid, Mangandioxid |
29) |
Natriumtetroxosulfat(VI) |
Na2SO4 |
30) |
Kaliumtetroxochlorat(VII) |
KClO4 |
31) |
Aluminiumoxid |
Al2O3 |
32) |
Distickstoffpentoxid |
N2O5 |
33) |
Kupfer(I)-trioxosulfat(IV) |
Cu2SO3 |
34) |
Hexaquoeisen(III)-chlorid |
[Fe(H2O)6]Cl3 |
35) |
Magnesiumtetroxophosphat(V) |
Mg3(PO4)2 |
36) |
Natriumdioxonitrat(III) |
NaNO2 |
37) |
Kaliumdioxochlorat(III) |
KClO2 |
38) |
Calciumtetracyanocuprat(II) |
Ca[Cu(CN)4] |
39) |
Disauerstoffmonofluorid |
O2F |
40) |
Natriumtetrachloroferrat(II) |
Na2[FeCl4] |
41) |
Lithiumtetrahydroxoaluminat |
Li[Al(OH)4] |
42) |
Eisen(II)-trioxosulfat(IV) |
FeSO3 |
43) |
Stickstoff(III)-oxid |
N2O3 |
44) |
Kaliumtetroxochlorat(VII) |
KClO4 |