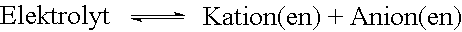
In der Geschichte der Chemie sind verschiedene Vorstellungen über das Wesen von Säuren und Basen entwickelt worden. Nach der Entdeckung des Sauerstoffs hatte dieser Jahrzehnte lang als das charakteristische Element der Säuren gegolten und war auf diese Weise zu seinem Namen gekommen.
Jede dieser Definitionen erscheint unter bestimmten Bedingungen vorteilhaft. Für ein Problem benützt man dasjenige Konzept, welches den Zweck am besten erfüllt.
Schmecken sauer, färben Lackmus rot, reagieren mit unedlen Metallen unter H2-Entwicklung.
Beispiele: Salzsäure, Schwefelsäure
Schmecken seifig, färben Lackmus blau.
Beispiele: Natronlauge, Kalilauge
Die Eigenschaften von Säuren und Basen heben sich auf.
Ein Gemisch aus sich entsprechenden Teilen ist weder sauer noch schmeckt es seifig und gibt Lackmus eine Mischfarbe.
Wird ein dissoziierbarer Stoff gelöst oder geschmolzen, so spaltet er sich teilweise und reversibel in positive Kationen und negative Anionen.
Dieser Vorgang heisst Elektrolytische Dissoziation, die sich so aufspaltenden Stoffe heissen Elektrolyte.
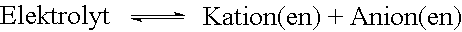
In wässriger Lösung oder als Schmelze leiten die Elektrolyten den elektrischen Strom, es sind Leiter 2. Klasse.
Drei Arten von Elektrolyten werden unterschieden:
Säuren sind Stoffe, die in wässriger Lösung in Wasserstoff-Ionen H+ und einen Säurerest dissoziieren.
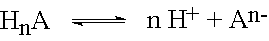
An- |
Säurerest |
n |
Wertigkeit der Säure (Anzahl dissoziierbare Wasserstoffatome im Säuremolekül) |
H+ |
hydratisierte Wasserstoff-Ionen |
Name der Säure |
Dissoziation |
Name des Säurerestes |
Kohlensäure |
|
-carbonat |
Salpetersäure |
|
-nitrat |
Salpetrige Säure |
|
-nitrit |
Phosphorsäure |
|
-phosphat |
Pyrophosphorsäure |
|
-pyrophosphat |
Schwefelwasserstoffsäure |
|
-sulfid |
Schwefelsäure |
|
-sulfat |
Schweflige Säure |
|
-sulfit |
Chlorsäure |
|
-chlorat |
Perchlorsäure |
|
-perchlorat |
Chlorwasserstoffsäure |
|
-chlorid |
Cyanwasserstoffsäure |
|
-cyanid |
Sauerstoffhaltige Säuren entstehen durch Umsetzung von Nichtmetalloxiden mit Wasser. Diese Nichtmetalloxide sind also Säureanhydride.

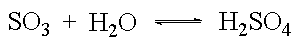
Auch von Metalloxiden, in denen das Metall mit der Oxidationszahl +V, +VI oder +VII auftritt, lassen sich Säuren ableiten.
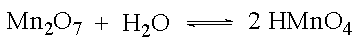
Bei Säuren, die mehrere dissoziierbare Wasserstoffatome im Molekül haben, bei sog. mehrwertigen Säuren, erfolgt die Dissoziation in mehreren Stufen.
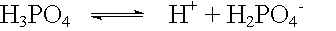
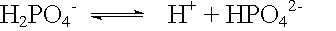
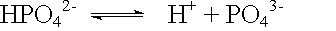
Basen sind Stoffe, die in wässriger Lösung Hydroxid-Ionen OH- abgeben.
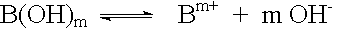
Bm+ |
Basenrest |
m |
Wertigkeit der Base (Anzahl dissoziierbare OH--Gruppen) |
H+ |
hydratisierte Hydroxid-Ionen |
Name der Base |
Dissoziation |
Natriumhydroxid |
|
Kaliumhydroxid |
|
Calciumhydroxid |
|
Bariumhydroxid |
|
Eisen(III)-hydroxid |
|
Aluminiumhydroxid |
|
Der Name des Basenrestes entspricht dem Namen des Metallkations.
Basen entstehen aus Metalloxiden oder unedlen Metallen mit Wasser.

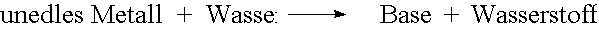


Salze sind Verbindungen, die in der Schmelze oder in wässrigen Lösungen in Metall-Kationen und Säurerest-Anionen dissoziieren.
Die Neutralisation einer Säure bzw. Base ergibt nach Arrhenius ein Salz und Wasser.

Die eigentliche chemische Reaktion besteht dabei in der Vereinigung von H+ und OH- zu Wasser.
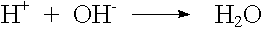
Werden mehrwertige Säuren und Basen nur teilweise neutralisiert, entstehen saure Salze. Dem Namen des Säurerestes wird die Silbe -hydrogen vorangestellt.
Beispiele
Neutralisation |
Name des Salzes |
HNO3 + NaOH |
Natriumnitrat |
H2SO4 + 2KOH |
Kaliumsulfat |
2HCl + Ca(OH)2 |
Calciumchlorid |
2H3PO4 + 3Ba(OH)2 |
Bariumphosphat |
H2SO3 + NaOH |
Natriumhydr.-sulfit |
H3PO4 + KOH |
Kaliumdihydr.phos. |
2HClO3 + Ca(OH)2 |
Calciumchlorat |
H3PO4 + 2KOH |
Kaliumhydrogenph. |
3HClO4 + Al(OH)3 |
Aluminiumperchlorat |
3H2SO4 + 2Al(OH)3 |
Aluminiumsulfat |
HCN + KOH |
Kaliumcyanid |
H2CO3 + Ca(OH)2 |
Calciumcarbonat |
H4P2O7 + 2Ba(OH)2 |
Bariumpyrophosphat |
2HNO2 + Ca(OH)2 |
Calciumnitrit |
2H3PO4 + Ca(OH)2 |
Ca-dihydrogenphos. |
3H4P2O7 + 2Al(OH)3 |
Al-dihydr.-pyroph. |
Ausser durch Neutralisation entstehen Salze auch auf folgende Arten:
| - | 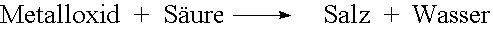 |
|
| Beispiel: |  |
|
| - | 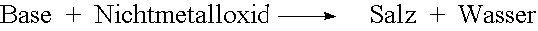 |
|
| Beispiel: |  |
|
| - |  |
|
| Beispiel: | 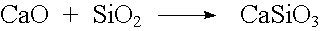 |
|
| - |  |
|
| Beispiel: | 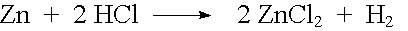 |
|
| - |  |
|
| Beispiel: | 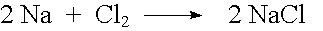 |
|
Der Dissoziationsgrad a eines Elektrolyten ist der Quotient aus der Anzahl der disoziierten Moleküle und der Anzahl der insgesamt vorhandenen Moleküle.
Auf Salze ist die Beziehung sinngemäss auf die Formeleinheit zu beziehen.
Der Dissoziationsgrad kann durch Leitfähigkeitsmessungen bestimmt werden, da die elektrische Leitfähigkeit proportional zur Konzentration an frei beweglichen Ionen ist.
Da sich die freien Ionen in höheren Konzentrationen gegenseitig behindern, ist der Dissoziationsgrad ausser von der Temperatur auch von der Konzentration abhängig.
Je nach Dissoziationsgrad unterscheidet man starke und schwache Säuren und Basen.
Stärke |
Dissoziationsgad in % |
Beispiele |
sehr stark |
70 - 100 |
Salzsäure |
stark |
20 - 70 |
Schwefelsäure |
mittelstark |
1 - 20 |
Phosphorsäure |
schwach |
0,1 - 1 |
Essigsäure |
sehr schwach |
< 0,1 |
Kohlensäure |
Die Beschränkung der Arrhenius-Begriffe auf das Lösungsmittel Wasser und die Einschränkung des Base-Begriffes auf hydroxidhaltige Substanzen machten eine Erweiterung der Begriffe "Säure" und "Base" notwendig.
Eine verdünnte Säurelösung enthält in Wirklichkeit keine freien H+-Ionen. Diese werden nach der Freisetzung von einem freien Elektronenpaar eines Wassermoleküls gebunden, sodass H3O+-Ionen, sog. Hydroxonium- oder Hydronium-Ionen, entstehen. Die Reaktion beim Lösen einer Säure in Wasser muss also folgendermassen formuliert werden:

Dabei wird ein H+-Ion, ein Proton, vom Säuremolekül auf ein Wassermolekül übertragen.
Um alle derartigen Reaktionen behandeln zu können, wurden die Säure- und Base-Begriffe wie folgt erweitert:
Säuren sind Stoffe oder Teilchen, die imstande sind H+-Ionen (Protonen) abzugeben. Es sind Protonen-Donatoren.
Basen sind Stoffe oder Teilchen, die H+-Ionen (Protonen) aufnehmen können. Es sind Protonen-Akzeptoren.
Säuren und Basen nach Brönsted charakterisieren nicht mehr bestimmte Stoffe, sondern eine bestimmte Funktion, nämlich die Fähigkeit, Protonen abzugeben oder aufzunehmen.
Als Säuren treten Teilchen auf, die polar gebundenen Wasserstoff enthalten. Basen weisen freie Elektronenpaare auf, mit denen sie das Proton kovalent binden können.
Da freie Protonen wegen ihrer im Verhältnis zur Grösse hohen Ladung nicht existieren können, kann eine Säure ihre Protonen nur dann abgeben, wenn eine Base zugegen ist.
Somit besteht nach der Brönsted-Theorie eine Säure-Base-Reaktion in einem reversiblen Protonen-Übergang von einer Säure auf eine Base. Eine solche Gleichgewichtsreaktion bezeichnet man als Protolyse.

Bei der Rückreaktion wirkt das Anion der Säure A- als Base. Man kann Protolysengleichgewichte deshalb als Konkurrenz zweier Basen (B und A-) um das Proton auffassen.
Die Base A-, die durch Protonenabgabe aus der Säure HA entstanden ist wird als konjugierte Base der Säure HA bezeichnet. Ebenso ist BH+ die konjugierte Säure der Base B. Die Paare HA/A- und BH+/B sind konjugierte Säure/Base-Paare. An jeder Protolysen-Reaktion sind zwei solche konjugierte Säure/Base-Paare beteiligt.

Beispiele (links steht immer die Säure):
HCl/Cl- |
NH4+/NH3 |
HSO4-/SO42- |
H3O+/H2O |
HS-/S2- |
H2O/OH- |
H2S/HS- |
HCN/CN- |
Säure 1 |
+ |
Base 2 |
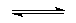 |
Base 1 |
+ |
Säure 2 |
HCl |
+ |
NH3 |
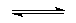 |
Cl- |
+ |
NH4+ |
HS- |
+ |
OH- |
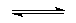 |
S2- |
+ |
H2O |
H3O+ |
+ |
HS- |
 |
H2O |
+ |
H2S |
HSO4- |
+ |
CN- |
 |
SO42- |
+ |
HCN |
NH4+ |
+ |
H2O |
 |
NH3 |
+ |
H3O+ |
H2O |
+ |
CN- |
 |
OH- |
+ |
HCN |
Stoffe oder Teilchen, die je nach Reaktionspartner sowohl als Säure, wie auch als Base reagieren können, werden als Ampholyten bezeichnet.
Wasser ist ein Ampholyt und kann sich selbst schwach protolysieren.

Wendet man auf diese Gleichgewichtsreaktion das Massenwirkungsgesetz an, erhält man:
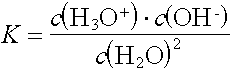
Die Stoffmengenkonzentration der Wassermoleküle kann als konstant betrachtet und in die Konstante einbezogen werden:
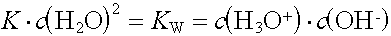
KW wird als Ionenprodukt des Wassers bezeichnet. Es ist eine konstante Grösse und beträgt bei 25°C
KW = 10-14 mol2/L2.
Die an einer Protolyse beteiligten Basen konkurrenzieren sich um ein Proton. Die Lage des Protolysengleichgewichts gibt Auskunft darüber, welches die stärkere Base ist. Es ist diejenige Base, die zum grösseren Teil als konjugierte Säure vorliegt als die andere. Auf ähnliche Weise kann aus der Gleichgewichtslage auch auf die stärkere Säure geschlossen werden.
Die folgenden Protolysengleichgewichte sind alle nach der Seite der Produkte verschoben. Daraus lässt sich eine Rangliste für die beteiligten Säuren resp. Basen nach abnehmender Säure- resp. Basenstärke ableiten:
H3O+ + H2PO4- |
 |
H3PO4 + H2O |
HCN + OH- |
 |
H2O + CN- |
H3PO4 + CN- |
 |
HCN + H2PO4- |
H2O + NH2- |
 |
NH3 + OH- |
Stärke der Säuren: H3O+ > H3PO4 > HCN > H2O > NH3
Stärke der Basen: NH2- > OH- > CN- > H2PO4- > H2O
Je stärker eine Säure ist, umso schwächer ist ihre konjugierte Base und umgekehrt.
Die Stärke von Säuren und Basen kann somit nur relativ angegeben werden. Als Bezugspunkt hat man den Ampholyten Wasser gewählt und aus dem Massenwirkungsgesetz des Protolysengleichgewichts einer Säure oder einer Base mit Wasser ein Mass für deren Säure- resp. Basenstärke abgeleitet.

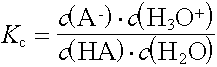
In verdünnten wässrigen Lösungen (bis cà. 1 mol/L) kann die Stoffmengenkonzentration der Wassermoleküle als konstant (55,6 mol/L) betrachtet und in die Konstante einbezogen werden.
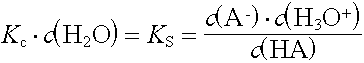
Die Säurekonstante KS ist umso grösser, je stärker die Säure ist.
Die Säurekonstante ist wie alle Gleichgewichtskonstanten temperaturabhängig. Aufgrund der Vereinfachung in der Ableitung vom Massenwirkungsgesetz ist sie nur für verdünnte Lösun-gen anwendbar. In diesem Bereich ist sie als konstant zu betrachten.
Starke Säuren haben KS-Werte über 10 mol/L, sehr schwache unter 10-10 mol/L. Zwecks Vereinfachung solch grosser und kleiner Werte gibt man oft nicht den KS-Wert in mol/L an, sondern seinen negativen Zehnerlogarithmus, den pKS-Wert.
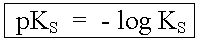
Beispiele |
Schwefelsäure |
KS = 103 mol/L |
pKS = -3 |
Phosphorsäure |
KS = 2,6·10-2 mol/L |
pKS = 1,6 |
|
Essigsäure |
KS = 1,8·10-5 mol/L |
pKS = 4,74 |
|
Blausäure |
KS = 1,6·10-10 mol/L |
pKS = 9,8 |
Analog zum KS-Wert einer Säure wird für die Basenstärke die Basenkonstante KB aus dem Massenwirkungsgesetz abgeleitet.

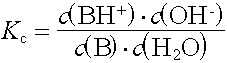
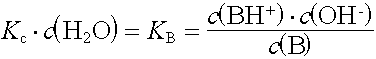
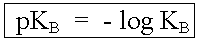
Die Basenkonstante KB ist umso grösser, je stärker die Base ist.
Beispiele:
1. |
Welchen pKS-Wert hat eine Säure, von der in einer 1 molaren Lösung noch 0,005 mol/L unprotolysierte Säure vorliegt ? |
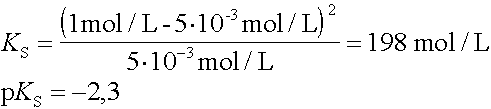 |
2. |
Welchen pKB-Wert hat eine Base, wenn in einer 0,2 mol/L Lösung eine OH-Ionenkonzentration von 3,8·10-2 mol/L gemessen wird ? |
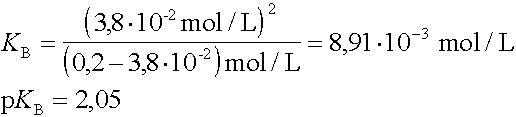 |
3. |
Wie viele Mol unprotolysierte Säure liegen in einem Liter Lösung vor, wenn pKS = 3,2 und c(H3O+) = 6·10-3 mol/L ? |
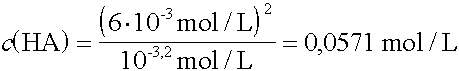 |
Zwischen der Säurekonstante KS und der Basenkonstante KB eines konjugierten Säure/Base-Paares besteht ein Zusammenhang:
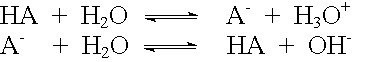
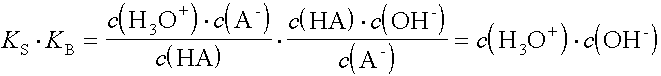
Für ein konjugiertes Säure/Base-Paar gilt somit:
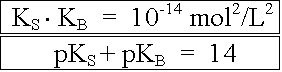
Die Stärke einer Säure oder Base lässt sich in verdünnten Lösungen vereinfacht auch durch den Protolysengrad a ausdrücken.
Der Protolysengrad a ist das Verhältnis aus der Konzentration der protolysierten Teilchen und der Konzentration der gelösten Säure oder Base vor der Protonenübertragung.
Aus stöchiometrischen Gründen ist die Konzentration der protolysierten Teilchen gleich der H3O+- resp. der OH--Konzentration. Damit gilt:

Durch Verdünnen einer Säure oder Base bleibt die Gleichgewichtskonstante der Protolyse zwar konstant, aber die Konzentrationen verschieben sich gemäss dem Prinzip von Le Châtelier zugunsten der protolysierten Teilchen. Der Protolysengrad ist somit nicht nur wie die Säure- und Basenkonstante temperaturabhängig, sondern auch konzentrationsabhängig und steigt mit zunehmender Verdünnung.
Starke Säuren oder Basen protolysieren bei Konzentrationen unter 1 mol/L immer vollständig. Ihr Protolysegrad ist deshalb 1 oder 100 %.
Bei schwachen Säuren und Basen ist die Konzentration an protolysierten Teilchen in nicht allzugrosser Verdünnung viel kleiner als die Konzentration an gelöster Säure oder Base. Der Protolysegrad ist somit viel kleiner als 1.
1. |
Eine Base mit c(B) = 0,5 mol/L hat eine OH--Ionenkonzentration c(OH-) = 0,01 mol/L. Wie gross ist der Protolysengrad der Base ? |
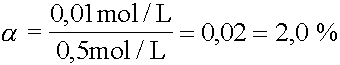 |
2. |
Welche H3O+-Ionenkonzentration hat eine 0,1 molare Lösung einer Säure mit dem Protolysengrad a = 5 % ? |
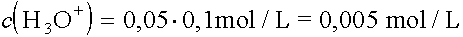 |
3. |
Welchen KB-Wert hat eine Base, die in einer Konzentration von 1 mol/L einen Protolysengrad von 0,1 % aufweist ? |
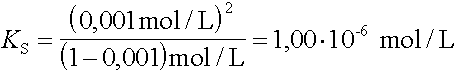 |
4. |
Welchen Protolysengrad hat eine 0,1 molare Basenlösung, wenn die Base einen pKB-Wert von 4,5 aufweist ? |
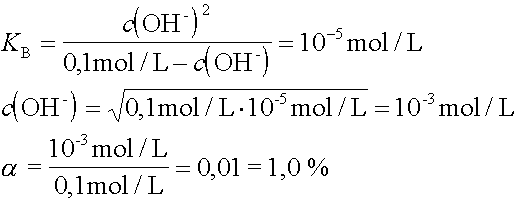 |
Wird eine Säure in Wasser gegeben, entstehen durch die Protolyse des Wassers H3O+-Ionen. Diese sogenannten Hydroxoniumionen sind verantwortlich für die sauren Eigenschaften der entstandenen Lösung. Ebenso sind die beim Lösen einer Base in Wasser entstehenden OH--Ionen oder Hydroxidionen verantwortlich für die alkalischen Eigenschaften dieser Lösung.
Gibt man nun eine wässrige Säure-Lösung und eine äquivalente Menge einer wässrigen Base-Lösung zusammen, so ist die Mischung weder sauer noch alkalisch, sie ist neutral. Die Hydroxoniumionen und die Hydroxidionen haben sich exotherm zu Wasser vereinigt und das Ionenprodukt des Wassers hat sich eingestellt.

Die konjugierte Base der Säure und die konjugierte Säure der Base haben an der Reaktion nicht teilgenommen. Die Gleichung für die Neutralisation kann somit vereinfacht werden:

Die Bildung von Wasser aus Hydroxonium- und Hydroxidionen ist eine praktisch vollständig verlaufende Protolyse, d.h. das Gleichgewicht ist sehr stark zum Produkt Wasser hin verschoben und bildet die Rückreaktion zur Autoprotolyse des Wassers.
Neutralisationsreaktionen werden in der Praxis und für die quantitative Analyse allerdings meist als einseitig verlaufend betrachtet und als Stoffgleichungen nach Arrhenius formuliert.
Die Hydroxonium- und die Hydroxidionen einer wässrigen Lösung sind wie gesagt die Träger der sauren respektive alkalischen Eigenschaften dieser Lösung. Wie stark sauer oder alkalisch eine Lösung ist, kann deshalb durch die H3O+- oder die OH--Ionenkonzentration angegeben werden. Weil sich die eine aus der anderen über das Ionenprodukt des Wassers errechnen lässt, genügt es auch, nur eine der beiden Konzentrationen zu messen oder anzugeben. Allgemein wird aus praktischen Gründen die H3O+-Ionenkonzentration als Charakteristikum für saure und alkalische Lösungen verwendet.
Für die z.T. sehr kleinen Konzentrationen ist es auch hier zweckmässig, statt die Stoffmengenkonzentrationen in mol/L, nur deren negative Zehnerlogarithmen, den sogenannten pH, zu benutzen.
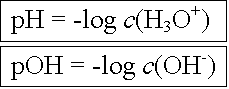
In einer wässrigen Löung ist das Produkt aus der Hydroxoniumionenkonzentration und der Hydroxidionenkonzentration stets gleich dem Ionenprodukt des Wassers KW. Daraus ergeben sich folgende Zusammenhänge:
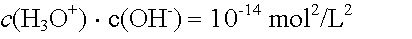

Saure, alkalische und neutrale Lösungen können somit wie folgt charakterisiert werden:
c(H3O+) |
pH |
||
neutral |
c(H3O+) = c(OH-) |
10-7 mol/L |
7 |
sauer |
c(H3O+) > c(OH-) |
> 10-7 mol/L |
< 7 |
alkalisch |
c(H3O+) < c(OH-) |
< 10-7 mol/L |
> 7 |
Starke Säuren und Basen protolysieren in Wasser praktisch vollständig. Das heisst, die H3O+-Ionenkonzentration ist gleich der Konzentration an gelöster Säure oder die OH--Ionenkonzentration ist gleich der Konzentration an gelöster Base. Die Ionen des Wassers können bei nicht allzu starker Verdünnung vernachlässigt werden.
- Welchen pH weist eine 0,001 molare Säure auf ?
pH = -log 10-3 mol/L = 3
- Welchen pH weist eine 0,2 molare Natronlauge auf ?
pOH = -log 0,2 mol/L = 0,7
pH = 14 - 0,7 = 13,3
Mit Hilfe des Protolysengrades von schwachen Säuren und Basen kann der pH ebenfalls berechnet werden. Dabei folgt aus der Definition des Protolysengrades:
c(H3O+) = a · c(HA) |
c(OH-) = a · c(B) |
(In stark verdünnten Lösungen müssen eventuell die Ionen des Wassers mitberücksichtigt werden.)
- Eine 0,1 molare Kaliumhydrogencarbonatlösung protolysiert zu 0,01 % basisch. Welchen pH weist
die Lösung auf ?
pOH = -log (0,0001 · 0,1mol/L) = -log 10-5mol/L = 5
pH = 14 - 5 = 9
- Eine 0,1 molare Essigsäure weist einen pH von 3 auf. Wie gross ist ihr Protolysengrad ?
a = 10-pHmol/L : c(HA) = 10-3mol/L : 0,1mol/L = 0,01
Mit Hilfe der pK-Werte lässt sich eine pH-Berechnung nur näherungsweise durchführen, weil in der Konstanten die Gleichgewichtskonzentrationen eingesetzt sind und die Auflösung zu einer Gleichung 2. Grades führen würde.
Schwache Säuren und Basen protolysieren aber so schwach, dass ihre Gleichgewichtskonzentrationen c(HA) resp. c(B) den Ausgangskonzentrationen c(HA) resp. c(B) näherungsweise gleich gesetzt werden können.
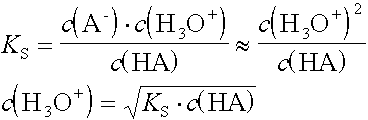
- Welchen pH-Wert hat eine HCN-Lösung mit einer Ausgangskonzentration c(HCN) = 0,05 mol/L ?
KS(HCN) = 4·10-10 mol/L
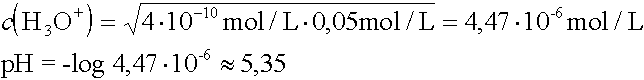
- Berechnen Sie den pH-Wert einer Ammoniak-Lösung mit c(NH3) = 0,02 mol/L, wenn der pKB-Wert von
Ammoniak 4,75 beträgt.
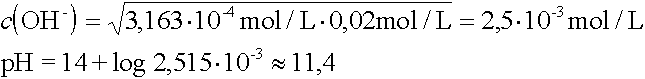
Die erste Protolysenstufe einer mehrstufigen Säure ist immer der Hauptlieferant an Hydroxoniumionen. Die weiteren Stufen weisen einen um etwa vier Zehnerpotenzen kleineren KS-Wert auf und können vernachlässigt werden.
Die Ionen eines gelösten Salzes können entsprechend ihrer Säure- oder Basenstärke mit Wasser protolysieren. Überwiegt eine dieser Protolysen, so reagiert die wässrige Lösung des Salzes sauer oder alkalisch.
Ionen protolysieren Wasser dann, wenn sie zum konjugierten Säure/Basen-Paar einer schwachen Säure oder Base gehören. Die Reaktion ist umso deutlicher, je schwächer die zum Ion konjugierte Säure oder Base ist.
Dissoziation: |
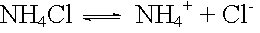 |
|
saure Protolyse: |
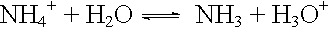 |
pKA = 10 |
basische Protolyse: |
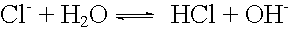 |
pKB = 20 |
saure Protolyse überwiegt, Lösung sauer |
||
Dissoziation: |
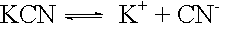 |
|
saure Protolyse: |
keine |
|
basische Protolyse: |
 |
pKB = 5 |
Lösung sauer |
||
Dissoziation: |
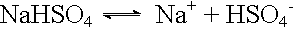 |
|
saure Protolyse: |
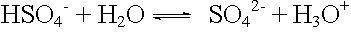 |
pKA = 2 |
basische Protolyse: |
 |
pKB = 17 |
saure Protolyse überwiegt, Lösung sauer |
||
Dissoziation: |
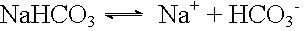 |
|
saure Protolyse: |
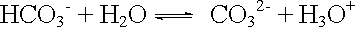 |
pKA = 11 |
basische Protolyse: |
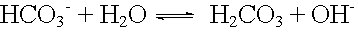 |
pKB = 8 |
basische Protolyse überwiegt, Lösung alkalisch |
||
Aus den obigen Betrachtungen lassen sich folgende Regeln ableiten:
Salze aus schwachen Basen und starken Säuren ergeben saure Lösungen.
Salze aus starken Basen und schwachen Säuren ergeben alkalische Lösungen.
Merke:
Als "saures Salz" bezeichnet man ein Salz, das noch protolysierbaren Wasserstoff enthält (es gibt auch solche, die in wässriger Lösung trotzdem alkalisch reagieren).
Alkalihydroxide können als alkalisch reagierende Salze der extrem schwachen Säure Wasser betrachtet werden.
Schwermetall-Ionen bilden in Wasser Aquakomplexe. Aus der Hydrathülle dieser Ionen können Protonen ans Wasser abgegeben werden und die Lösung reagiert sauer. Der Effekt ist umso stärker, je kleiner das Metall-Ion und je grösser dessen Ladung ist.
Eisen(III)-chlorid
Dissoziation: |
 |
Hydratation: |
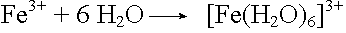 |
Protolyse: |
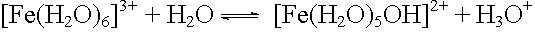 |
Säure-Base-Puffer sind wässrige Systeme, die ihren pH-Wert bei Hydroxonium- oder Hydroxid-Ionenzugabe sowie beim Verdünnen innerhalb ihres Pufferbereiches aufrecht erhalten.
Ein Puffer besteht in der Regel aus einem Gemisch einer schwachen Säure und ihrem Natriumsalz der konjugierten Base (Säurepuffer) oder aus einer schwachen Base und ihrem Chloridsalz der konjugierten Säure (Basepuffer).
Der pH-Wert einer Pufferlösung kann näherungsweise aus der Säure resp. Basenkonstanten berechnet werden.

Wegen der schwachen Protolyse kann die Konzentration an konjugierter Säure oder Base neben derjenigen aus dem Salz vernachlässigt werden. Aus demselben Grund kann die Konzentration an unprotolysierter Säure oder Base im Gleichgewicht gleich der Konzentration an eingesetzter Säure oder Base gesetzt werden.
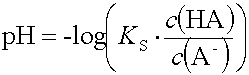 |
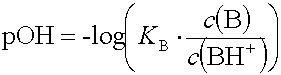 |
Der pH einer Pufferlösung hängt von der Säurekonstanten (Basenkonstanten) und dem Verhältnis aus der Säurekonzentration (Basenkonzentration) und der Salzkonzentration ab.
Beim Verdünnen der Pufferlösung bleibt das Stoffmengenverhältnis erhalten und somit der pH konstant.
Sind die beiden Stoffmengenkonzentrationen gleich gross (Quotient ist 1), entspricht der pH der Pufferlösung dem pKS der Säure resp. 14 - pKB der Base. Beispiele:
| 1. | Welchen pH hat eine Lösung von Essigsäure und Natriumacetat im Molverhältnis 1 : 100 ? |
pH = -log (1,8·10-5mol/L · 0,01 = 6,7 |
| 2. | In 100 mL Ammoniaklösung mit c = 1,00 mol/L werden 0,010 mol Ammoniumchlorid gelöst. |
pH = 14 + log (3,3113·10-5mol/L · (1/0,1)) = 10,5 |
| 3. | In 100 mL 0,10 molarer Essigsäurelösung (CH3COOH) werden 5,0 g Natriumacetat (CH3COONa) gelöst. Welchen pH weist die so "abgestumpfte" Säurelösung auf ? |
c(CH3COONa) = 10·5g/L:82g/mol = 0,609756 mol/L |
| 4. | Eine 1 molare Ammoniaklösung hat einen pH von 11,8. Welcher pH stellt sich in 250 mL Lösung nach der Zugabe von 30 g Ammoniumchlorid NH4Cl ein ? |
c(NH4Cl) = 4·30g/L:53,5g/mol = 2,24299 mol/L pH = 14 + log(3,4·10-5mol/L · 1mol/L : 2,24299mol/L = 9,18 |
Die Pufferkapazität ist ein Mass für die maximale Aufnahme von H3O+-Ionen beziehungsweise OH--Ionen.
Puffer mit grosser Kapazität haben eine hohe Gesamtkonzentration und enthalten die Komponenten in gleichen Stoffmengenanteilen.
Säurepuffer |
 |
Säurezugabe
Die überschüssigen H3O+-Ionen werden von der konjugierten Base aus dem Salz zu unprotolysierter Säure und Wasser gebunden.
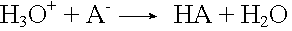
Basenzugabe
Die zugegebenen OH--Ionen neutralisieren die H3O+-Ionen im Gleichgewicht. Diese werden aus der unprotolysierten schwachen Säure durch Protolyse nachgeliefert.
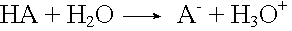
Basepuffer |
 |
Säurezugabe
Die zugegebenen H3O+-Ionen neutralisieren die OH--Ionen im Gleichgewicht. Diese werden aus der unprotolysierten schwachen Base durch Protolyse nachgeliefert.
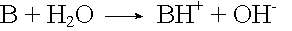
Basenzugabe
Die überschüssigen OH--Ionen werden von der konjugierten Säure aus dem Salz zu unprotolysierter Base und Wasser gebunden.

Es gibt eine Vielzahl von Puffergemischen, die je nach Zusammensetzung und Mischungsverhältnis der Komponenten insgesamt den ganzen pH-Bereich von 1 bis 13 abdecken.
Citratpuffer |
pH 3 |
Citronensäure/Natriumcitrat |
Acetatpuffer |
pH 5 |
CH3COOH/CH3COONa |
Phosphatpuffer |
pH 7 |
NaH2PO4/Na2HPO4 |
Ammoniakpuffer |
pH 9 |
NH4+/NH3 |
Borsäurepuffer |
pH 9 |
H3BO3/NaH2BO3 |
Carbonatpuffer |
pH 10 |
NaHCO3 (Ampholyt) |
Reaktion bei Säure-/Basenzugabe
Acetatpuffer
Säurezugabe: |
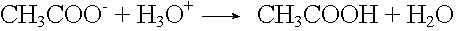 |
Basenzugabe: |
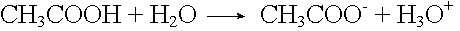 |
Ammoniakpuffer
Säurezugabe: |
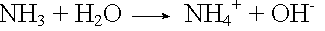 |
Basenzugabe: |
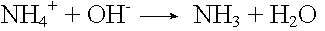 |
Phosphatpuffer
Säurezugabe: |
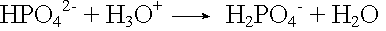 |
Basenzugabe: |
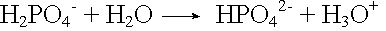 |
Carbonatpuffer
Säurezugabe: |
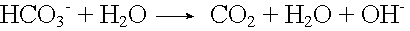 |
Basenzugabe: |
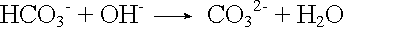 |
Säure-Basen-Indikatoren sind Farbstoffe, die in saurem und alkalischem Milieu verschiedene Farben aufweisen.
Dazu müssen die Indikatoren selbst schwache Säuren oder Basen sein, deren Protolysengrad vom pH abhängig ist und die in protolysierter Form eine andere Farbe haben als in unprotolysierter. Je nach pH herrscht dann die Farbe der protolysierten Form oder diejenige der unprotolysierten vor.
| Indikatorsäure |  |
Säurezugabe
Die H3O+-Ionen werden durch Ind--Ionen zu IndH und Wasser gebunden. c(Ind-) nimmt daher ab und c(IndH) zu. Sobald c(IndH) > c(Ind-), nimmt die Lösung die Farbe der unprotolysierten Indikatorsäure (rot) an.
Basenzugabe
Die neutralisierten H3O+-Ionen werden durch das Indikatoren- gleichgewicht nachgeliefert. c(IndH) nimmt deshalb ab, c(Ind-) zu. Sobald c(Ind-) > c(IndH), nimmt die Lösung die Farbe der protolysierten Indikatorsäure (blau) an.
Merke:
Eine schwache Säure liegt in saurer Lösung unprotolysiert, in alkalischer Lösung protolysiert vor.
Eine schwache Base liegt in saurer Lösung protolysiert, in alkalischer Lösung unprotolysiert vor.
Im Umschlagspunkt ist c(IndH) = c(Ind-) (Mischfarbe). Damit gilt:
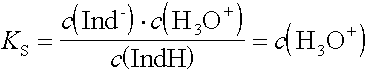
Umschlags-pH = pKS
| Indikatorbase | 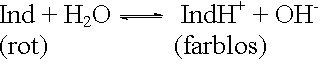 |
Säurezugabe
Die neutralisierten OH--Ionen werden durch das Indikatorengleichgewicht nachgeliefert. c(Ind) nimmt deshalb ab, c(IndH+) zu. Sobald c(IndH+) > c(Ind), nimmt die Lösung die Farbe der protolysierten Indikatorbase (farblos) an.
Basenzugabe
Die OH--Ionen werden durch IndH+-Ionen zu Ind und Wasser gebunden. c(IndH+) nimmt daher ab und c(Ind) zu. Sobald c(Ind) > c(IndH+), nimmt die Lösung die Farbe der unprotolysierten Indikatorbase (rot) an.
Im Umschlagspunkt ist c(Ind) = c(IndH+) (Mischfarbe). Damit gilt:
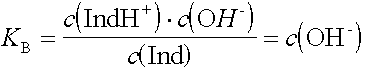
Umschlags-pH = 14 - pKB
Beispiele
Indikator |
Umschlags-pH |
Farbumschlag |
Methylorange |
4 |
rot - gelb |
Methylrot |
5,5 |
rot - gelb |
Lakmus |
6 |
rot - blau |
Phenolphthalein |
8,5 |
farblos - rot |
Bei Titrationen muss derjenige Indikator gewählt werden, dessen Umschlagspunkt in der Nähe des Äquivalenzpunktes liegt (Hydrolyse !).
Tropft man eine ungepufferte Lösung, deren pH bei etwa 7 liegt, auf einen Indikatorstreifen, riskiert man Fehlablesungen, weil die Protonenaufnahme (oder Protonenabgabe) des Indikators selbst den pH verfälschen kann.
Auch bei Titrationen wird der Indikator mittitriert und soll deshalb nur sehr sparsam eingesetzt werden.